Produkter
Hvert år behandles 2,4 millioner pasienter1 verden over med ALKs produkter for allergivaksinasjon. ALKs produktutvalg omfatter også diagnostiske produkter og en adrenalinpenn til akuttbehandling.
Du har valgt en lenke som fører til et eksternt nettsted. alkpro.at er ikke ansvarlig for innholdet eller personvernerklæringen på dette nettstedet. Vi anbefaler at du leser personvernerklæringen for hvert nettsted du besøker. Klikk «Avbryt» for å gå tilbake til ALK eller «Fortsett» for å fortsette.
Hvert år behandles 2,4 millioner pasienter1 verden over med ALKs produkter for allergivaksinasjon. ALKs produktutvalg omfatter også diagnostiske produkter og en adrenalinpenn til akuttbehandling.
Allergivaksinasjon kan administreres på to ulike måter: som injeksjoner eller som tabletter. ALK tilbyr begge typene og dekker på den måten de vanligste luftveisallergiene.
Ved pollenallergi kan symptomene oppleves som meget plagsomme og mange blir ofte veldig trøtte. Når allergien påvirker hverdagen, bør pasienten kontakte legen sin.
I 2006 lanserte ALK verdens første registrerte allergivaksinasjon i tablettform. Den sublinguale tabletten tas daglig av pasienten hjemme i en periode på tre år. Allergivaksinasjon i tablettform er den mest veldokumenterte av behandlingsformene.1
ALKs varemerker:


Allergivaksinasjon i injeksjonsform (SCIT) gis som regelmessige subkutane injeksjoner. Behandlingen gis i en periode på tre til fem år, og i løpet av denne perioden injiserer legen pasienten med det allergenet han eller hun er allergisk mot. Behandlingen består av en oppdoseringsfase med ukentlige injeksjoner i praksis i 7uker1 og i henhold til indikasjon 15 uker2og samt en vedlikeholdsfase hvor pasienten får en ny injeksjon cirka hver 6-8 uke.
ALKs varemerker:
Ved pollenallergi kan symptomene oppleves som meget plagsomme og mange blir ofte veldig trøtte. Når allergien påvirker hverdagen, bør pasienten kontakte legen sin.
I tillegg til behandlingsprodukter fremstiller ALK også allergenekstrakter som brukes til allergidiagnostikk ved prikktester. En prikktest måler reaktiviteten hos mastcellene/mastcellebundne IgE-antistoffer i blodet. Prinsippet er å provosere frem en biologisk reaksjon ved å tilføre kroppen en liten mengde av allergenet.
Prikktesten gjøres ved å påføre en liten dråpe allergenekstrakt på pasientens underarm. Deretter perforerer man huden ved hjelp av en lansett, slik at en liten mengde av allergenet trenger gjennom huden. Hvis pasienten er allergisk, oppstår det en hudreaksjon bestående av en kvaddel og rødhet. Ved pollenallergi kan symptomene oppleves som meget plagsomme og mange blir ofte veldig trøtte. Når allergien påvirker hverdagen, bør pasienten kontakte legen sin.
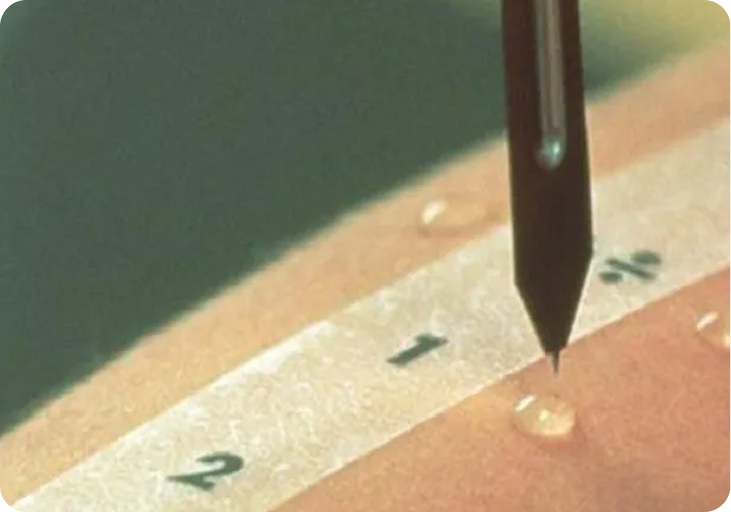
Allergenekstrakt til prikktekst
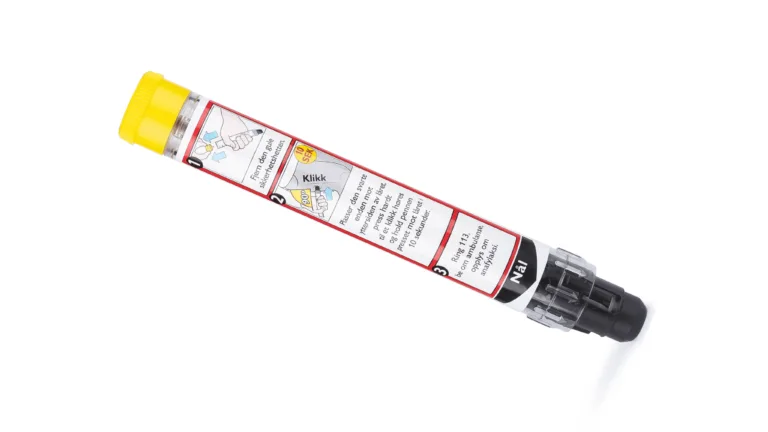
Autoinjektor adrenalin
ALK har utviklet en adrenalinpenn for behandling av alvorlige akutte allergiske reaksjoner (anafylaksi). Pasienter med matvareallergi eller en ubehandlet allergi mot insektgift kan ha risiko for anafylaksi hvis de ved en feiltakelse utsettes for allergenet.
Den anbefalte akuttbehandlingen ved anafylaksi er en intramuskulær adrenalininjeksjon, og deretter må man umiddelbart ringe 113. Adrenalinet virker umiddelbart i det kardiovaskulære og respiratoriske systemet og motvirker de eventuelle livstruende effektene som har oppstått ved allergenkontakt. Det får blodårene til å trekke seg raskt sammen for å opprettholde blodtrykket, sørger for at musklene i lungene slapper av og gjør det lettere å puste, motvirker hevelse og stimulerer hjertet.
Ved pollenallergi kan symptomene oppleves som meget plagsomme og mange blir ofte veldig trøtte. Når allergien påvirker hverdagen, bør pasienten kontakte legen sin.
ALKs produkter
[1] ALK Annual Report 2022: https://ml-eu.globenewswire.com/Resource/Download/ea4f16db-19f3-45a3-9d4d-79408c5b7dc4 (globenewswire.com)
*********
Allergivaksinasjon
[1] ALK Annual Report 2022: https://ml-eu.globenewswire.com/Resource/Download/ea4f16db-19f3-45a3-9d4d-79408c5b7dc4 (globenewswire.com)
*********
Injeksjoner
[1] Roald Bolle, Aud Berstad, Erik Florvaag, Sverre Steinsvåg, Praktisk veileder i allergivaksinasjon, 2. utgave 2011, Norsk kvalitetssikringsdokument, for Hyposensibilisering – Allergenspesifikk immunterapi – Allergivaksinasjon, Norsk Forening for Allergologi og Immunpatologi.
[2] www.felleskatalogen.no
GRAZAX® Sublingvalt lyofilisat. Standardisert allergenekstrakt av gresspollen fra timotei (Phleum pratense) 75 000 SQ-T. Indikasjon: Sykdomsmodifiserende behandling av gresspollenindusert rhinitt og konjunktivitt hos voksne og barn fra fem år med kliniske relevante symptomer som er diagnostisert med en positiv hudprikktest og/eller spesifikk IgE-test for gresspollen. Dosering: 1 sublingvalt lyofilisat daglig. Behandling bør kun initieres av leger med erfaring i behandling av allergiske sykdommer og som kan behandle allergiske reaksjoner. For at pasient og lege skal kunne drøfte eventuelle bivirkninger og mulige tiltak, er det anbefalt at det første sublingvale lyofilisatet tas under tilsyn av lege (20-30 minutter). Klinisk effekt i gresspollensesongen oppnås dersom behandling innledes minst 4 måneder før forventet start av gresspollensesongen og fortsettes gjennom sesongen. Kontraindikasjoner: Overfølsomhet for hjelpestoffene. Malignitet eller systemiske sykdommer som har påvirkning på immunsystemet. Inflammatoriske tilstander i munnhulen med alvorlige symptomer. Ukontrollert eller alvorlig astma (voksne: FEV1 < 70 %, barn: FEV1 < 80 % av den anslåtte verdi etter tilfredsstillende farmakologisk behandling). Advarsel og forsiktighetsregler: Alvorlige systemiske allergiske reaksjoner: Det er rapportert om alvorlige anafylaktiske reaksjoner, i noen tilfeller ved doser etter oppstartsdosen. Hvis det oppstår alvorlige systemiske reaksjoner må lege kontaktes umiddelbart. Alvorlige anafylaktiske reaksjoner kan behandles med adrenalin. Vurder om pasienten vil kunne tolerere adrenalin (f.eks. behandling med TCA, MAO-hemmere, COMT-hemmere og/eller betablokkere) i tilfelle en alvorlig systemisk allergisk reaksjon skulle oppstå. Pasienter med hjertesykdom kan ha økt risiko i tilfelle alvorlige systemiske allergiske reaksjoner. Astma: Er en kjent risikofaktor for alvorlige systemiske allergiske reaksjoner. Pasienter med astma må informeres om behovet for å oppsøke medisinsk hjelp umiddelbart dersom deres astma plutselig forverres. Hos pasienter med astma som opplever en akutt luftveisinfeksjon, bør igangsettelse av behandling utsettes til infeksjonen er løst. Eosinofil øsofagitt: Hos pasienter med alvorlige eller varige gastroøsofageale symptomer, bør seponering vurderes. Graviditet og amming: Behandling bør ikke innledes under graviditet. Det antas at spedbarn som ammes ikke blir påvirket. Bivirkninger: Milde til moderate lokale allergiske reaksjoner kan forekomme tidlig i behandlingen, men disse har tendens til å avta spontant innen 1-7 dager. Hyppigst rapportert er oral pruritus, halsirritasjon og ødem i munnen. I fleste tilfeller starter reaksjonen innen 5 minutter etter inntak, og avtar etter minutter til timer. Mer alvorlige lokale eller systemiske allergiske reaksjoner kan forekomme. Reseptgruppe: C Pakninger og priser: 30 stk. (blister), Vnr 02 54 25, 1156,60 kr; 100 stk. (blister), Vnr 02 57 36, 3770,70 kr. Refusjonsberettiget bruk: Behandling av gresspollenindusert rhinitt og konjunktivitt hos barn > 5 år og voksne med klinisk relevante symptomer. Refusjonskoder: ICPC: F71 Allergisk konjunktivitt, R97 Allergisk rhinitt. ICD: H10.1 Allergisk (akutt atopisk) konjunktivitt, J30 Vasomotorisk og allergisk rhinitt. Vilkår: 206: Refusjon ytes kun når følgende vilkår er oppfylt: - Pasienten har hatt moderat til alvorlig sesongavhengig gresspollenindusert rhinitt eller konjunktivitt i minst to år. - Optimal symptomatisk behandling gir ikke tilstrekkelig sykdomskontroll eller kan ikke brukes av tungtveiende medisinske grunner. - Allergi er påvist med positiv hudprikktest og/eller spesifikk IgE test for gresspollen. - Ved oppstart skal injisert gresspollen velges fremfor sublingvale formuleringer hvis pasienten samtidig får injeksjon med andre allergenekstrakter.
Innehaver av markedsføringstillatelsen: ALK-Abelló A/S, Bøge Allé 6-8, 2970 Hørsholm, Danmark.
Basert på SPC godkjent av DMP 07.02.2025
ITULAZAX® Sublingvalt lyofilisat. Standardisert allergenekstrakt av pollen fra bjørk (Betula verrucosa) 12 SQ-Bet. Indikasjon: Voksne og barn fra 5 år: Moderat til alvorlig allergisk rhinitt og/eller konjunktivitt indusert av pollen fra den homologe bjørkegruppen1. Pasienter med en klinisk anamnese med symptomer til tross for bruk av symptomlindrende legemidler, og en positiv test for sensibilisering til et medlem av den homologe bjørkegruppen (prikktest og/eller spesifikk IgE).
1 Bjørk, or, agnbøk, hassel, eik, bøk. Dosering: 1 sublingvalt lyofilisat daglig. Behandling bør initieres av lege med erfaring i behandling av allergiske sykdommer. Behandling initieres utenfor pollensesongen og fortsettes i trepollensesongen. Klinisk effekt i trepollensesongen (homolog bjørkegruppe) er vist når behandling startes minst 16 uker før forventet start av trepollensesongen (homolog bjørkegruppe), og fortsettes gjennom hele sesongen. Det første sublingvale lyofilisatet bør tas under medisinsk tilsyn, og pasienten bør overvåkes i minst 30 minutter for å kunne diskutere, og ev. behandle, ev. umiddelbare bivirkninger. Kontraindikasjoner: Overfølsomhet for hjelpestoffene. FEV1 <70% av anslått verdi (etter tilfredsstillende farmakologisk behandling) ved behandlingsstart. Alvorlig astmaeksaserbasjon eller ukontrollert astma i løpet av de siste 3 månedene før behandlingsstart. Aktive systemiske autoimmune lidelser (responderer ikke på behandling) og immundefekter, -svikt eller -suppresjon. Malign neoplastisk sykdom med aktuell sykdomsrelevans. Akutt alvorlig oral betennelse eller munnsår. Advarsler og forsiktighetsregler: Alvorlige systemiske allergiske reaksjoner: Behandlingen seponeres og lege skal kontaktes umiddelbart. Et alternativ for å behandle alvorlige systemiske allergiske reaksjoner er adrenalin. Effekten av adrenalin kan forsterkes hos pasienter som behandles med TCA, MAO- og/eller COMT-hemmere, noe som kan få fatale følger. Adrenalineffekten kan reduseres hos pasienter som behandles med betablokkere. Pasienter med hjertesykdom kan ha økt risiko ved alvorlige systemiske allergiske reaksjoner. Astma: Er en kjent risikofaktor for alvorlige systemiske allergiske reaksjoner. Alvorlig astmaeksaserbasjon i løpet av de 12 siste månedene er en kjent risikofaktor for fremtidig eksaserbasjon. Astmatikere må informeres om behovet for å søke medisinsk hjelp umiddelbart ved plutselig astmaforverring. Hos pasienter med astma som får en akutt luftveisinfeksjon bør behandlingsstart utsettes til infeksjonen er løst. Eosinofil øsofagitt: Hos pasienter med alvorlige eller vedvarende gastroøsofageale symptomer må behandling avbrytes og medisinsk evaluering søkes. Autoimmune sykdommer i remisjon: Forsiktighet utvises. Graviditet og amming: Behandling bør ikke startes under graviditet. Det er ikke forventet noen effekt på spedbarn som ammes. Bivirkninger: Primært forventes det at milde til moderate lokale allergiske reaksjoner oppstår i løpet av de første dagene og forsvinner innen noen måneder (i mange tilfeller innen 1-2 uker). I de fleste tilfeller må reaksjonen forventes å starte innen 10 minutter etter inntak, og avta innen 1 time. Alvorligere lokale allergiske reaksjoner kan oppstå. Reseptgruppe: C Pakninger og priser: 30 stk. (blister), Vnr 08 13 44, 1331,80 kr; 90 stk. (blister), Vnr 46 25 44, 3922,80 kr.
Refusjonsberettiget bruk: Til behandling av voksne pasienter med moderat til alvorlig allergisk rhinitt og/eller konjunktivitt, med en sykehistorie med symptomer til tross for symptomlindrende behandling og en positiv hudprikktest og/eller spesifikk IgE-test. Refusjonskoder: ICPC: F71 Allergisk konjunktivitt, R97 Allergisk rhinitt. ICD: H10.1 Allergisk (akutt atopisk) konjunktivitt, J30 Vasomotorisk og allergisk rhinitt. Vilkår: 248: Refusjon ytes kun når følgende vilkår er oppfylt: - Pasienten har hatt moderat til alvorlig sesongavhengig bjørkepollenindusert rhinitt eller konjunktivitt i minst to år. - Optimal symptomatisk behandling gir ikke tilstrekkelig sykdomskontroll eller kan ikke brukes av tungtveiende medisinske grunner. - Allergi er påvist med positiv hudprikktest og/eller spesifikk IgE-test for bjørkepollen. - Ved oppstart skal injisert bjørkepollen velges fremfor Itulazax hvis pasienten samtidig får injeksjon med andre allergenekstrakter. 250: Refusjon ytes kun til voksne fra og med 18 år.
Innehaver av markedsføringstillatelsen: ALK-Abelló A/S, Bøge Allé 6-8, 2970 Hørsholm, Danmark. Basert på SPC godkjent av DMP 04.12.2025.
ACARIZAX® Sublingvalt lyofilisat. Standardisert allergenekstrakt fra husstøvmidd Dermatophagoides pteronyssinus og Dermatophagoides farinae 12 SQ-HDM. Indikasjon: Voksne (18-65 år) diagnostisert med sykehistorie og en positiv hudprikktest og/eller spesifikk IgE-test mot husstøvmidd med minst 1 av følgende tilstander: Vedvarende moderat til alvorlig allergisk rhinitt mot husstøvmidd til tross for bruk av symptomlindrende legemidler. Allergisk astma mot husstøvmidd som ikke er velkontrollert med inhalasjonskortikosteroider og samtidig mild til alvorlig allergisk rhinitt mot husstøvmidd. Pasientens astmastatus må grundig evalueres før behandlingsstart. Barn (5-17 år) diagnostisert med sykehistorie og en positiv hudprikktest og/eller spesifikk IgE-test mot husstøvmidd med vedvarende moderat til alvorlig allergisk rhinitt forårsaket av husstøvmidd til tross for bruk av symptomlindrende legemidler. Dosering: 1 sublingvalt lyofilisat daglig. Behandling bør initieres av lege med erfaring i behandling av allergiske sykdommer. Klinisk effekt er forventet 8-14 uker etter oppstart. Det første sublingvale lyofilisatet bør tas under medisinsk tilsyn, og pasienten bør overvåkes i minst en halv time, for å kunne drøfte og behandle eventuelle umiddelbare bivirkninger. Kontraindikasjoner: Overfølsomhet for hjelpestoffene. FEV1 <70 % av anslått verdi (etter tilfredsstillende farmakologisk behandling) ved initiering av behandling. Alvorlig astmaeksaserbasjon i løpet av siste 3 måneder. Hos astmatikere med akutt luftveisinfeksjon, bør behandlingsstart utsettes til infeksjonen er leget. Aktive eller dårlig kontrollerte autoimmune sykdommer, immundefekter, immunsvikt, immunsuppresjon eller malign neoplastisk sykdom med aktuell sykdomsrelevans. Akutt alvorlig betennelse eller munnsår. Advarsel og forsiktighetsregler: Astma: Er en kjent risikofaktor for alvorlige systemiske allergiske reaksjoner. Pasienten må informeres om behovet for å søke medisinsk hjelp umiddelbart hvis deres astma forverres plutselig. Acarizax bør initialt brukes som tilleggsbehandling, og ikke som en erstatning for eksisterende astmamedisinering. Brå seponering av astmamedisiner etter initiering av behandling anbefales ikke. Reduksjoner i astmamedisiner bør utføres gradvis og under tilsyn av lege iht. retningslinjer for astmabehandling. Alvorlige systemiske allergiske reaksjoner: Pasienten skal seponere behandlingen og kontakte lege umiddelbart. Et alternativ for å behandle alvorlige systemiske allergiske reaksjoner er adrenalin. Effekten av adrenalin kan forsterkes hos pasienter som behandles med TCA, MAO-hemmere og/eller COMT-hemmere, noe som kan få fatale følger. Effekten av adrenalin kan være redusert ved beta-blokker behandling. Pasienter med hjertesykdom kan ha økt risiko ved systemiske allergiske reaksjoner. Eosinofil øsofagitt: Ved alvorlige/vedvarende gastroøsofageale symptomer, må behandling avbrytes og medisinsk evaluering søkes. Autoimmune sykdommer i bedring: Forsiktighet utvises. Graviditet og amming: Behandling bør ikke startes under graviditet. Det antas at spedbarn som ammes ikke blir påvirket. Bivirkninger: Primært forventes at milde til moderate lokale allergiske reaksjoner oppstår i løpet av de første dagene og går over med fortsatt behandling (1-3 måneder). I de fleste tilfeller må reaksjonen forventes å starte innen 5 minutter etter inntak, og avta etter minutter eller timer. Alvorligere orofaryngeale allergiske reaksjoner kan oppstå. Alvorlig akutt forverring av astmasymptomer er sett. Alvorlige systemiske allergiske reaksjoner, inkl. anafylaksi, er sett, også ved doser etterfølgende startdosen. Reseptgruppe: C Pakninger og priser: 30 stk. (blister), Vnr 55 50 47, 1181,50 kr; 90 stk. (blister), Vnr 18 67 48, 3232,90 kr. Refusjonsberettiget bruk: Behandling av vedvarende moderat til alvorlig allergisk rhinitt mot husstøvmidd til tross for bruk av symptomlindrende legemidler hos barn > 5 år og voksne. Behandling av allergisk astma mot husstøvmidd som ikke er velkontrollert med inhalasjonskortikosteroider og samtidig mild til alvorlig allergisk rhinitt mot husstøvmidd hos voksne. Refusjonskoder: ICPC: R96 Astma, R97 Allergisk rhinitt. ICD: J30 Vasomotorisk og allergisk rhinitt, J45 Astma. Vilkår: 238: Refusjon ytes kun når følgende vilkår er oppfylt: - Optimal symptomatisk behandling gir ikke tilstrekkelig sykdomskontroll eller kan ikke brukes av tungtveiende medisinske grunner. - Allergi er påvist med positiv hudprikktest og/eller spesifikk IgE test for husstøvmidd. - Behandling med Acarizax skal kun startes opp av spesialist med allergologisk kompetanse.
Innehaver av markedsføringstillatelsen: ALK-Abelló A/S, Bøge Allé 6-8, 2970 Hørsholm, Danmark. Basert på SPC godkjent av DMP 10.01.2025.
Alutard SQ Bigift. Alutard SQ Vepsegift. Injeksjonsvæske, suspensjon. Allergenekstrakt av bigift fra Apis mellifera eller av vepsegift fra Vespula spp. 100 SQ-U/ml, 1000 SQ-U/ml, 10 000 SQ-U/ml og 100 000 SQ-U/ml. Indikasjon: Allergen immunterapi for pasienter med dokumentert sykehistorie med generelle og/eller systemiske IgE medierte allergiske reaksjoner pga. følsomhet mot bigift (fra Apis mellifera) eller mot vepsegift (fra Vespula spp.), bekreftet av hudprikktest og/eller intradermal test og/eller spesifikk IgE test. Dosering: Behandling må utføres under overvåkning av lege med erfaring i spesifikk immunterapi. Etter hver injeksjon må pasienten observeres i minst 30 minutter. Dosen tilpasses individuelt iht. den allergene anamnesen og pasientens følsomhet. Behandlingen foregår i 2 faser: Oppdoserings- og vedlikeholdsfase. Under oppdoseringsfasen gis injeksjonene hver uke. Hensikten er å gradvis øke dosen til høyeste tolererte vedlikeholdsdose. Høyeste anbefalte vedlikeholdsdose er 100 000 SQ-U. Når vedlikeholdsdosen er nådd, økes gradvis intervallene mellom injeksjonene fra 1 til 2, 4 og 6 til 8 uker. Injeksjonene blir deretter gitt hver 6. til 8. uke i 3-5 år. Alutard SQ Bigift og Alutard SQ Vepsegift kan ikke byttes ut med andre immunterapipreparater som inneholder insektgift. For mer informasjon om doseringsskjema og dosejusteringer, f.eks. i tilfelle allergiske reaksjoner, ved forlenget tidsintervall mellom 2 besøk eller ved samtidig behandling med >1 allergen, se SPC. Barn <5 år: Spesielt nøye nytte-/risikovurdering. Barn ≥5 år: Begrensede data vedrørende effekt, men data vedrørende sikkerhet viser ikke høyere risiko enn for voksne, nytte-/risikovurdering anbefales. Kontraindikasjoner: Overfølsomhet for hjelpestoffene. Aktive eller dårlig kontrollerte systemiske autoimmune sykdommer og immunsviktsykdommer. Sykdommer eller tilstander der en indusert anafylaktisk reaksjon innebærer en uakseptabel risiko, slik som alvorlig hjerte-/karsykdom. Astmapasienter med risiko for forverring og/eller med inadekvat symptomkontroll definert som nærvær av: tap av symptomkontroll innen de siste 4 ukene. Advarsler og forsiktighetsregler: For forsiktighetsregler relatert til administreringen (når injeksjonen bør utsettes, forsiktighetsregler før og etter injeksjon), se SPC. Alvorlige systemiske allergiske reaksjoner: Komplett gjenopplivingsutstyr og legemidler, inkl. adrenalin og trent personell, for behandling av alvorlige allergiske reaksjoner, skal være tilgjengelig. Kardiovaskulær sykdom: Pasienter med hjertesykdom kan ha økt risiko ved systemiske allergiske reaksjoner. Pasienter med kardiovaskulær sykdom må være godt behandlet for underliggende tilstand før behandlingsoppstart. Autoimmun sykdom: Behandling kan kun startes opp ved sykdomsremisjon eller godt justert terapi. Malign neoplastisk sykdom: Behandling kan kun startes opp når den maligne sykdommen er stabil, ved forverring bør behandlingen avbrytes. Mastocytose: Pasienter med økt utgangspunkt av serumtryptase og/eller mastocytose kan ha økt risiko for å utvikle systemiske allergiske reaksjoner og alvorligheten av disse kan være økt. Pasienten bør overvåkes nøye under behandling. Mindre effekt av behandlingen kan forventes. Astma: Er en kjent risikofaktor for alvorlige systemiske allergiske reaksjoner. Astmasymptomer bør kontrolleres adekvat før behandlingsoppstart. Spesiell forsiktighet bør utvises, og pasientens astmatilstand må vurderes før hver injeksjon. Pasienten må informeres om behovet for å søke medisinsk hjelp umiddelbart ved plutselig astmaforverring. Andre populasjoner: Det er en teoretisk risiko for aluminiumakkumulering hos pasienter med høy risiko, dvs. ved nedsatt nyrefunksjon eller samtidig behandling med andre aluminiumholdige legemidler (f.eks. antacida). Bilkjøring og bruk av maskiner: Kan i enkelte tilfeller påvirke evnen til å kjøre bil eller bruke maskiner pga. vertigo. Interaksjoner: Samtidig symptomatisk behandling med antiallergika kan øke toleransenivået mot allergeninjeksjoner, hvilket må vurderes ved seponering av slike legemidler. ACE-hemmere: Pasienter som samtidig behandles med ACE-hemmere kan ha høyere risiko for å utvikle alvorligere anafylaktiske reaksjoner og bør derfor overvåkes nøye under oppdoseringsfasen. ACE hemmere kan redusere effekten av behandlingen. TCA, MAO hemmere, COMT hemmere, betablokkere: Effekten av adrenalin kan forsterkes hos pasienter som behandles med TCA, MAO-hemmere og/eller COMT-hemmere, og gi fatale følger. Effekten av adrenalin kan være redusert ved betablokkerbehandling. I tillegg kan effektene av adrenalin forverre kardiovaskulær sykdom, f.eks. forårsake hjertearytmi. Pasienter som får behandling med betablokkere bør overvåkes nøye under oppdoseringsfasen. Graviditet og amming: Behandling bør ikke startes opp under graviditet. Dersom graviditet oppstår under vedlikeholdsbehandling, kan behandlingen fortsette etter nøye vurdering av pasientens generelle tilstand og reaksjoner på tidligere injeksjoner med preparatet. Ingen effekt på spedbarn som ammes er forventet. Bivirkninger: Generelt oppstår reaksjoner pga. en immunologisk reaksjon (lokal og/eller systemisk) mot bigift/vepsegift. Umiddelbar reaksjon vises innen de første 30 minuttene etter injeksjon, senreaksjon vises innen de første 24 timene. Lokale reaksjoner på injeksjonsstedet er vanlig. Alvorligste bivirkning er anafylaktisk sjokk. Atopisk dermatitt kan bli forverret under behandling. Ukjent frekvens: Gastrointestinale: Dysfagi, diaré, oppkast, kvalme, magesmerter. Hjerte: Takykardi, palpitasjoner. Kar: Hypotensjon, blekhet, ansiktsrødme. Hud: Urticaria, pruritus, utslett, erytem, angioødem, opphovnet ansikt. Immunsystemet: Systemiske allergiske reaksjoner inkl. anafylaktisk sjokk. Luftveier: Tetthet i halsen, pipende pust, hoste, dyspné, astma, halsirritasjon, tetthet i nesen (bigift). Muskel-skjelettsystemet: Artralgi, hovne ledd. Nevrologiske: Hodepine, svimmelhet, parestesi. Øre: Vertigo. Øye: Øyelokksødem, konjunktivitt (bigift), pruritus i øyet. Øvrige: På injeksjonsstedet kan hevelse, urticaria, misfarging (vepsegift), noduler, smerte, granulomer, hematomer (vepsegift), erytem, pruritus og hypertrikose forekomme. Varmefølelse, følelse av fremmedlegeme, perifer hevelse, brystubehag, fatigue, nedsatt allmenntilstand. Reseptgruppe: C Pakninger og priser: Startpakning 4x5 ml (hettegl.) 5731,60 kr (Vnr 439807 (bigift), 6245,70 (Vnr 421243 (vepsegift)); 5 ml (hettegl.) 5978,50 (Vnr 504661 (bigift), 6800,20 kr (Vnr 464500 (vepsegift)).
Refusjonsberettiget bruk: Allergen immunterapi for pasienter med en dokumentert sykehistorie med generelle og/eller systemiske IgE-medierte allergiske reaksjoner på grunn av følsomhet mot bigift (Apis mellifera)/vepsegift (Vespula spp.), bekreftet av hudprikktest og/eller intradermal test og/eller spesifikk IgE-test. Refusjonskoder: ICPC: A92 Allergi/allergisk reaksjon IKA.
ICD: T78.2 Uspesifisert anafylaktisk sjokk, T78.3 Angionevrotisk ødem. Vilkår: Ingen spesifisert.
Innehaver av markedsføringstillatelsen: ALK-Abelló A/S, Bøge Allé 6-8, 2970 Hørsholm, Danmark. Basert på SPC godkjent av DMP 24.11.2025 (Alutard SQ Bigift) og 04.11.2025 (Alutard SQ Vepsegift).
Alutard SQ Bjørk. Alutard SQ Timotei. Injeksjonsvæske, suspensjon. Depotallergenekstrakt fra bjørkepollen (Betula verrucosa) eller timoteipollen (Phleum pratense). Startpakning: 100 SQ-U/ml, 1000 SQ-U/ml, 10 000 SQ-U/ml, 100 000 SQ-U/ml. Vedlikeholdspakning: 100 000 SQ-U/ml. Indikasjon: Behandling av Type I allergi. Dosering: Behandling bør gjennomføres av helsepersonell med erfaring i allergenspesifikk immunterapi. Pasienten skal alltid observeres etter hver injeksjon i minst 30 minutter. Behandlingen foregår i 2 faser: Oppdoserings- og vedlikeholdsfase. Oppdoseringsfase: Anbefalt startdose: De fleste tolererer 0,2 ml av 100 SQ-U/ml. Injeksjonen gis vanligvis 1 gang hver uke. For hver behandling er målet å øke dosene til 100 000 SQ-U (optimal behandling ift. effekt og sikkerhet) eller til nærmeste maks. tolererte dose er oppnådd. Dosen skal alltid tilpasses individuelt, avhengig av pasientens følsomhet overfor allergenet, allmenntilstand, tidsintervall for sist dose, og ev. allergiske reaksjoner i forbindelse med tidligere injeksjoner. Se SPC for forslag till veiledende oppdosering. Vedlikeholdsfase: Når vedlikeholdsdosen er nådd gjennom ukentlige injeksjoner, anbefales en trinnvis økning av intervallene mellom injeksjonene. Intervaller på 2, 4 og 6 uker bør følges. Vedlikeholdsdoser gis deretter hver 6. uke +/- 2 uker i 3-5 år. For mer informasjon om dosereduseringer i tilfelle allergiske reaksjoner, ved overskridelse av tidsintervall mellom 2 injeksjoner, ved sesongbetont allergi eller ved endring i hetteglass og parti, se SPC. Barn <5 år: Regnes normalt å være uegnede for hypersensibilisering. Barn >5 år: Sparsomme kliniske data om effektiviteten. Sikkerhetsdata viser imidlertid at det ikke foreligger høyere fare enn hos voksne. Kontraindikasjoner: Overfølsomhet for hjelpestoffene. Pasienter med FEV1 <70% av predikert verdi hos voksne og FEV1 <80% av predikert verdi hos barn og ungdom (etter adekvat farmakologisk behandling). Alvorlig astmaforverring innen de 3 siste månedene. Systemiske sykdommer som påvirker immunsystemet sterkt (f.eks. immunkomplekssykdommer, immundefektsykdommer). Utslag av kronisk hjerte-/lungesykdommer (kan komplisere behandlingen og redusere sjansen for klinisk bedring). Terapi med betablokkere. Restitusjon fra en anafylaktisk reaksjon ved bruk av adrenalin kan forhindres av betablokkere. Vær spesielt varsom når betablokkere brukes da de kan hindre responsen på adrenalinet. Nytt anfall med kraftige allergiske reaksjoner ved korrekt administrert behandling. Ved nyresvikt (pga. høy risiko for opphoping av aluminium). Alvorlige hudlidelser inkl. utbredt pruriginøst eksem. Tuberkulose. Advarsler og forsiktighetsregler: For forholdsregler før og etter hver injeksjon, se SPC. Alvorlige systemiske allergiske reaksjoner: Komplett gjenopplivningsutstyr og legemidler, inkl. adrenalin til injeksjon og trent personell, for behandling av alvorlige anafylaktiske reaksjoner skal være øyeblikkelig tilgjengelig. Pasienter med hjertesykdom kan ha økt risiko ved alvorlige systemiske allergiske reaksjoner. Astma: Astmasymptomer bør kontrolleres adekvat de 3 siste månedene før behandlingsoppstart. Pasientens astmatilstand må vurderes før hver injeksjon. Behandlingen bør holdes tilbake hvis pasientens astmastatus ikke er fullstendig kontrollert den siste uken før den planlagte injeksjonen. Pasienter må informeres om behovet for å søke medisinsk hjelp umiddelbart ved plutselig astmaforverring. Hos astmatikere som får en akutt luftveisinfeksjon, bør behandling utsettes til infeksjonen er gått over. Bilkjøring og bruk av maskiner: Utmattelse kan forekomme hos enkelte etter injeksjon. Interaksjoner: Samtidig terapi med symptomatiske antiallergiske midler kan påvirke toleransenivået. Effektene av adrenalin kan forsterkes ved TCA-, MAO-hemmer- og/eller COMT-hemmerbehandling, med mulige fatale konsekvenser. Effektene av adrenalin kan reduseres ved betablokkerbehandling. Ved behov for samtidig behandling av >1 spesiell allergi, kan injeksjonene settes om hverandre og gis på ulike steder med en 1/2 times mellomrom. Injeksjon med andre antigener, f.eks. tetanus, bør ikke utføres tidligere enn 1 uke etter siste injeksjon med Alutard SQ. Inntak av store mengder antacida som inneholder aluminium, bør unngås. Graviditet og amming: Behandling bør ikke startes dersom pasienten er gravid. Behandling under graviditet må bare gjøres dersom fordelen oppveier risikoen. Dersom graviditet oppstår under behandling må risiko av fortsatt behandling vurderes nøye, og behandlingen kan fortsette etter vurdering av pasientens generelle tilstand (herunder lungefunksjon) og reaksjoner på tidligere injeksjoner med preparatet. Hos pasienter med eksisterende astma anbefales tettere oppfølging under graviditeten. Utskillelse i morsmelk er ukjent. Bivirkninger: Reaksjoner oppstår som regel pga. en immunologisk reaksjon (lokal og/eller systemisk) mot respektive allergen. Symptomer på straksreaksjon oppstår i løpet av 30 minutter etter injeksjonen. Symptomer på senreaksjon kommer vanligvis i løpet av 24 timer etter injeksjonen. Innholdet av aluminium kan bidra til at det oppstår lokale bivirkninger. Atopisk dermatitt kan forverres under behandling. Svært vanlige: Reaksjon på injeksjonsstedet (kløe, opphovning, urtikaria, erytem, noduli, smerter, blåmerker, hematom, indurasjon, inflammasjon, ødem, utslett, varme, misfarging, papel, lokalisert ødem og smerter på administrasjonsstedet). Vanlige: Anafylaktisk reaksjon, konjunktivitt, rødme, kløe i ørene, vertigo, pipende pust, hoste, dyspné, astma, tett nese, allergisk rhinitt, nysing, irritasjon i halsen, rhinoré, kløe i nesen, magesmerter, diaré, oppkast, kvalme, dyspepsi, urtikaria, kløe, utslett, erytem, eksem, ubehag, utmattelse, frysninger, varmefølelse, følelse av et fremmedlegeme i halsen. Mindre vanlige: Anafylaktisk sjokk, hevelse i øyelokkene, hevelse i ansiktet. Ukjent frekvens: Svimmelhet, parestesi, palpitasjoner, takykardi, cyanose, hypotensjon, blekhet, bronkospasmer, tett hals, angioødem, opphovning i ledd, leddsmerter, ubehag i brystet, hypertrikose på injeksjonsstedet.
Reseptgruppe: C Pakninger og priser: Alutard SQ Bjørk, startpakning, 4x5 ml (Vnr 545996) 5829,80 kr; Alutard SQ Bjørk, 100 000 SQ-U/ml, 1x5 ml (Vnr 546002) 5829,80 kr. Alutard SQ Timotei, startpakning, 4x5 ml (Vnr 546044) 6335,60 kr; Alutard SQ Timotei, 100 000 SQ-U/ml, 1x5 ml (Vnr 546051) 6335,60 kr.
Refusjonsberettiget bruk: Behandling av type I-allergi. Refusjonskoder: ICPC: F71 Allergisk konjunktivitt, R97 Allergisk rinitt. ICD: H10.1 Allergisk (akutt atopisk) konjunktivitt, J30 Vasomotorisk og allergisk rinitt. Vilkår: 88 Årsaken må være påvist ved allergologiske prøver.
Innehaver av markedsføringstillatelsen: ALK-Abelló A/S, Bøge Allé 6-8, 2970 Hørsholm, Danmark. Basert på SPC godkjent av DMP 14.01.2025 (Alutard SQ Bjørk) og 03.02.2025 (Alutard SQ Timotei).
Jext. Adrenalin, injeksjonsvæske, oppløsning i ferdigfylt penn (autoinjektor). Klar og fargeløs oppløsning, fri for synlige partikler.
Indikasjon: Akuttbehandling ved alvorlige allergiske reaksjoner (anafylaksi) mot insektgift, matvarer, legemidler og andre allergener, samt ved anafylaktisk sjokk utløst av idiopatiske årsaker eller trening.
Dosering: Voksne og barn over 30 kg: Normal dose er 300 mikrogram. Større voksne kan ha behov for mer enn 1 injeksjon. Barn og ungdom 15-30 kg: Normal dose er 150 mikrogram. Startdosen skal gis så snart symptomer på anafylaktisk sjokk oppstår. I fravær av klinisk forbedring eller om forverring oppstår, kan en 2. injeksjon gis med en ny penn etter 5-15 minutter. Det anbefales at pasienten alltid har med seg 2 penner. Settes i.m. anterolateralt på låret. For engangsbruk. Kan settes gjennom klærne.
Advarsler og forsiktighetsregler: Pasienten skal være grundig instruert til å forstå indikasjoner og riktig fremgangsmåte for administrering. Det anbefales i tillegg å instruere pasientens nærmeste. Fjern ikke den gule sikkerhetshetten før Jext er klar til bruk. Må ikke settes i setemuskulaturen. Etter 1. dose må pasienten instrueres i å ringe ambulanse (113), og opplyse om anafylaksi samt oppsøke legevakt umiddelbart for tett overvåkning og ev. ytterligere behandling. Pasient/hjelpepersonell må informeres om muligheten for bifasisk anafylaksi. Bevisste pasienter skal fortrinnsvis ligge flatt med føttene hevet, men sette seg opp ved pustevansker. Be¬visstløse pasienter skal plasseres i stabilt sideleie. Astmapasienter kan ha økt risiko for en alvorlig anafylaktisk reaksjon. Inneholder natriumme¬tabisulfitt som i sjeldne tilfeller kan gi alvorlige overfølsomhetsreaksjoner. Dersom injeksjonen utføres av en omsorgsperson, må pasienten instrueres om ikke å bevege seg og man bør passe på at pasientens ben holdes i ro under injeksjonen for å minimere risikoen for sårdannelse. Ved tykt underhudslag av fett, er det en risiko for at adrenalinet administreres i underhudslaget. Dette kan føre til langsommere absorpsjon og suboptimal effekt, og øke behovet for en ekstra injeksjon. Brukes med forsiktighet ved kardiovaskulære sykdommer inkludert angina pectoris, obstruktiv kardiomyopati, hjertearytmier, cor pulmonale, aterosklerose og hypertensjon. Vær også spesielt oppmerksom på pasienter med hypertyreoidisme, feokromocytom, trangvinklet glaukom, alvorlig nedsatt nyrefunksjon, prostataforstørrelse som fører til resturin, hyperkalsemi, hypokalemi og diabetes. Forsiktighet ved behandling av eldre og gravide. Utilsiktet injeksjon i hender og føtter kan føre til iskemi. Pasientene skal rådes til å kontrollere Jext regelmessig, og sikre at det skiftes ut før utløpsdatoen. Legemidlet inneholder mindre enn 1 mmol natrium (23 mg) i hver dose, og er så godt som "natriumfritt". Pasienter skal undersøkes mht. relaterte allergener slik at deres spesifikke allergener kan bli karakterisert.
Interaksjoner: Forsiktighet ved behandling av pasienter som behandles med legemidler som kan utløse hjertearytmi. Potenseringsrisiko med trisykliske antidepressiva (TCA), monoaminoksidasehemmere (MAO-hemmere) og katekol-O-metyltransferase-hemmere (COMT-hemmere), tyreoideahormoner, teofyllin, oksytocin, parasympatolytika, visse antihistaminer (difenhydramin, klorfeniramin), levodopa og alkohol. Ved bruk av adrenalin kan det være nødvendig for diabetikere å øke doseringen av insulin eller orale hypoglykemiske legemidler. Den alfa- og betastimulerende virkningen av adrenalin kan hemmes ved samtidig bruk av alfa- og betablokkere, samt parasympatomimetika.
Bivirkninger: Kardiovaskulære og sentralnervøse effekter forbundet med adrenalinets alfa- og betareseptoraktivitet. Hyperglykemi, hypokalemi, metabolsk acidose, tremor, svimmelhet, hodepine, parestesi, hypoestesi, palpitasjoner, takykardi, angina pectoris, arytmi, stresskardiomyopati, synkope, perifer iskemi, økt blodtrykk, kvalme, oppkast, munntørrhet, muskelstivhet, reaksjon på injeksjonsstedet, asteni, hyperhidrose, ubehag i brystet.
Graviditet og amming: Begrenset klinisk erfaring. Bør bare brukes under graviditet dersom potensiell nytte oppveier potensiell risiko for fosteret. Adrenalin er ikke oralt biotilgjengelig, og ev. utskillelse i morsmelk forventes ikke å ha noen effekt på diende spedbarn.
Reseptgruppe: C. Pakninger og priser: Jext 150 mikrogram, 1 ferdigfylt penn (autoinjektor), (Vnr 56 74 60) 57,50 NOK; Jext 300 mikrogram, 1 ferdigfylt penn (autoinjektor) (Vnr 18 36 60) 527,50 NOK.
Refusjonsberettiget bruk: Akuttbehandling ved alvorlig anafylaktisk sjokk eller allergisk reaksjon på allergener som insektgift, matvarer eller legemidler. Refusjonskoder: ICPC: A85 Anafylaktisk sjokk legemiddelbivirkning, A92 Allergi/allergisk reaksjon IKA. ICD: T78.0 Anafylaktisk sjokk som skyldes reaksjon på matvarer, T78.2 Uspesifisert anafylaktisk sjokk, T88.6 Anafylaktisk sjokk som skyldes bivirkninger av riktig legemiddel gitt i terapeutisk dose. Vilkår: 183 Refusjon ytes kun til 1) pasienter som har hatt en alvorlig allergisk reaksjon og som trenger tilgang til adrenalininjeksjon for å behandle eventuelle fremtidige allergireaksjoner. Allergi skal være diagnostisert ved objektive allergitester eller ved hjelp av sykdomshistorie og kliniske funn. Eller 2) pasienter med høy risiko for alvorlig allergisk reaksjon (for eksempel ved hjemmebehandling med legemidler til injeksjon/infusjon). Behandling etter punkt 2 skal institueres i sykehus eller av spesialist i øre-nese-halssykdommer, indremedisin, hud og veneriske sykdommer eller barnesykdommer.
Innehaver av markedsføringstillatelsen: ALK-Abelló A/S, Bøge Allé 6-8, 2970 Hørsholm, Danmark
Basert på SPC godkjent av DMP 16.10.2024.
Soluprick, Soluprick SQ. Oppløsning til prikktest. Soluprick Positiv kontroll: histamindihydroklorid 10 mg/ml. Soluprick Negativ kontroll: ingen aktive virkestoffer. Soluprick SQ Bjørk inneholder standardisert allergenekstrakt fra Betula verrucosa 10 HEP, Soluprick SQ Timotei fra Phleum pratense 10 HEP og Soluprick SQ Dermatophagoides pteronyssinus fra Dermatophagoides pteronyssinus 10 HEP. Indikasjon: In vivo-diagnostikk av spesifikk IgE-mediert allergi. Dosering: Hudprikktesten utføres ved å ha en dråpe av oppløsningen på hudoverflaten. Huden penetreres ved å bruke en lansett. Hudprikktesten utføres enten på den volare siden av underarmen eller på ryggen. Positiv og Negativ kontroll brukes som referanse. For bruksanvisning, se pakningsvedlegg eller kontakt ALK. Prikktesting av barn er mulig etter 1. leveår, avhengig av barnets tilstand, men bør generelt ikke utføres før barnet er 4 år. Kontraindikasjoner: Behandling med betareseptorblokkere, kronisk hjerte- eller lungesykdom eller alvorlig arteriell hypertoni, da dette kan påvirke behandlingen av ev. systemisk allergisk reaksjon. Immunologiske sykdommer, som f.eks. immunkompleks-sykdommer og defekter i immunsystemet. Akutt eller kronisk atopisk eksem. Overfølsomhet for hjelpestoffene. Advarsel og forsiktighetsregler Testen bør utsettes ved enhver tilstand som har innflytelse på pasientens allmenntilstand, hudlesjoner i testområdet, dermografisme, samt utbrutt dermatitt og eksem innenfor testområdet. Disse tilstandene kan ha innflytelse på fortolkningen av testresultatet. I tilfeller der det er utført en aksillær lymfekjerteldisseksjon, anbefales det å utføre prikktesten på motsatt arm. I ekstremt sjeldne tilfeller kan det oppstå systemisk allergisk reaksjon etter prikktesting med aktive allergenekstrakt. Utstyr for akutt behandling av anafylaksi bør være tilgjengelig ved gjennomføring av prikktesting, og pasienten må observeres i 30 minutter etter prikktest. Samtidig behandling med betablokkere kan påvirke behandlingen av anafylaksi. Interaksjoner: Ledsagende antiallergisk behandling kan ha innflytelse på resultatet av testen. Det anbefales at pasienter som skal ta en hudprikktest (SPT) avbryter behandling med:
Terapeutisk agens Intervall mellom siste dosering og SPT
Korttidsvirkende antihistaminer 2-3 dager
Langtidsvirkende antihistaminer 8 uker
Hydroksyzin 2 uker
Ketotifen 2 uker
Trisykliske antidepressiver 2 uker
Lokal applikasjon av potent steroidsalve 2-3 uker
Kortikosteroider i doser <30 mg prednison/prednisolon pr. dag i opptil 1 uke, reduserer ikke responsen på hudprikktesten. Langtidsbehandling med orale lavdoserte glukokortikoider (dose <10 mg prednisolon pr. dag) trenger ikke å avbrytes forut for hudprikktesten. Graviditet og amming: Risikoen ved å utføre en hudprikktest i løpet av svangerskapet må evalueres omhyggelig sammen med pasienten, for å kunne identifisere det spesielle kliniske behovet for å identifisere det utløsende allergenet i løpet av svangerskapet. Hudprikktesting kan utføres under amming. Bivirkninger: Bivirkninger ved prikktesting kan tilskrives en immunologisk respons (lokal og/eller systemisk) utløst av allergenet. Svært vanlige: Hud: Lokal reaksjon - kvaddelens diameter øker videre, pseudopodi. Vanlige: Hud: Lokale smerter. Sjeldne: Hud: Forsinket reaksjon i form av diffus hevelse, urticaria. Immunsystemet: Angioødem. Luftveier: Rhinitt, astma. Øye: Konjunktivitt. Svært sjeldne: Immunsystemet: Anafylaksi. Anafylaksi krever øyeblikkelige tiltak med adrenalin og annen akuttbehandling. Reseptgruppe: C Pakninger og priser: 2 ml (hettegl.) 138,60 kr (Vnr 02 46 81 Positiv kontroll, 02 46 03 Negativ kontroll); 2 ml (hettegl.) 213,30 kr (Vnr 02 46 22 Bjørk, 02 45 83 Timotei, 02 46 33 Dermatophagoides pteronyssinus). Innehaver av markedsføringstillatelsen: ALK-Abelló A/S, Bøge Allé 6-8, 2970 Hørsholm, Danmark. Basert på SPC godkjent av SLV 12.07.2024 (Soluprick SQ Timotei og Soluprick SQ Dermatophagoides pteronyssinus), 26.04.2024 (Soluprick SQ Bjørk), 14.04.2014 (Soluprick Positiv og Negativ kontroll).