Molekylærdiagnostikk har kommet til klinikken, men det betyr ikke at vi trenger å gjøre om på alt. Det mener Jørgen Nedergaard Larsen, Senior Scientist hos ALK.

Selv om de kliniske rutiner vi har i dag, er både gode og effektive, vil molekylærdiagnostikken sannsynligvis kunne øke nøyaktigheten innenfor enkelte veldefinerte områder, som for eksempel kryssreaktivitet og matvareallergi.
Tidligere i år gav European Academy of Allergy and Clinical Immunology ut en omfattende håndbok i molekylær allergologi,1 og World Allergy Organization (WAO) publiserte allerede for noen år siden et konsensusdokument om molekylærdiagnostikk.2
Allergidiagnose
Konsensusdokumentet fra WAO er relativt tydelig. Det viktigste aspektet ved allergidiagnostikk er en nøyaktig sykehistorie, som bekreftes ved hjelp av blodprøve og/eller prikktest.
Dette er i tråd med de fleste legers praksis. WAO sier også at en molekylærtest kan øke nøyaktigheten ved tvetydighet. I praksis gjelder dette først og fremst i tre tilfeller:
- skille mellom ekte og kryssreaktiv sensibilisering hos polysensibiliserte pasienter
- vurdere risikoen for alvorlige reaksjoner ved matvareallergi i spesielle tilfeller
- identifisere pasienter og utløsende allergener for allergivaksinasjon
Dette innebærer at pasienter med en tydelig sykdomshistorie sannsynligvis ikke har noe å vinne på molekylærdiagnostikk sammenlignet med tradisjonell diagnostisk praksis. Men hvis molekylærdiagnostikken utvikles slik at den kan erstatte for eksempel provokasjonstest ved matvareallergi, er det mye å vinne når det gjelder risiko, tid og ressurser.
Forbedre nøyaktigheten med molekylærdiagnostikk
Iblant tester allergiske pasienter positivt på flere ulike arter samtidig. Dette kan skyldes IgE-kryssreaktivitet, siden IgE reagerer med molekyler i ekstraktene som finnes i homologe varianter fra flere arter. Slik kryssaktivitet gjør det vanskelig å identifisere den egentlige sensibiliseringskilden, noe som er viktig før man starter med allergivaksinasjon. I mange tilfeller kan problemet løses ved å teste kjente allergener fra homologe arter.
Eksempel 1:
I Skandinavia reagerer pasienter med bjørkepollenallergi ofte på pollen fra beslektede trær som or og hassel. Ettersom bjørk er det klart vanligste treet, vil i prinsippet samtlige pasienter være sensibilisert mot bjørkepollen.3 De reagerer på or og hassel fordi pollen fra disse trærne inneholder homologe allergener som gir IgE-kryssreaktivitet. Slike pasienter bør vaksineres mot bjørkepollen. I Italia er derimot ikke bjørkepollen så vanlig, men i noen regioner dyrker man hassel til nøtteproduksjon. Pasienter fra disse regionene kan være sensibilisert mot hasselpollen og burde ideelt sett vaksineres mot hasselpollen.4
Eksempel 2:
Mange pasienter er sensibilisert mot både bi og veps ved blodprøve in vitro.5 Det egentlige antallet dobbeltsensibiliserte pasienter er imidlertid mye lavere. I dette tilfellet vil en test av fosfolipase A2 (som er spesifikt for honningbier) samt Ves v 5 (som er spesifikt for vepsearter i Vespula-familien) kunne skille mellom personer med biallergi og personer med vepseallergi.5
I andre tilfeller, for eksempel ved matvareallergi, er sensibilisering mot spesifikke molekyler spesielt knyttet til alvorlige allergiske reaksjoner. I silke tillfeller kan molekylærdiagnostikk bidra med nyttig informasjon omkring reaksjonens alvorlighetsgrad, noe som kan gi den enkelte pasient konkrete advarsler eller anbefalinger.1
I tillegg kan molekylærdiagnostikk forbedre nøyaktigheten ved identifisering av aktuelle pasienter for behandling med allergivaksinasjon. Her er korrekt spesifisitet viktig for å optimere nytte og ressursbruk når det gjelder tid og penger.
Sq-standardisering
Konseptet med molekyler er ikke nytt innen SQ-standardisering, som bygger på en teknikk som kalles immunelektroforese.6 Denne teknikken for fremstilling av allergenekstrakter ble først brukt på 1960-tallet av Henning Löwenstein, som i sin doktoravhandling beskrev hvordan enkeltpasienters molekylære IgE-spesifisitet kunne kartlegges med bare ett eksperiment.7
Teknikken er basert på at et allergenekstrakt kan separeres til molekyler gjennom reaksjon med et polyklonalt antistoff fra kaninserum gjennom et elektrisk felt. Resultatet blir et mønster av klokkeformede kurver, der hver kurve representerer et allergenmolekyl. Pasientserum kan helles på platen, og IgE fra serumet binder seg spesifikt til de allergenmolekylene pasienten er sensibilisert mot.

Figur 1. Krysset immunelektroforese
Kurverne er kun synlig for de molekylene som finnes i ekstraktet i tilstrekkelig mengde, og synliggjør et sterkt immunologisk svar hos verten, og det er dette som er karakteristisk for et allergen. Hver allergenkilde gir et spesifikt mønster, noe som muliggjør sammenligning av hver ny produksjonsenhet med en “in house reference”. Dette sikrer full kompleksitet i hver produksjonsenhet.
Teknikken er semi-kvantitativ, og det visuelle mønsteret som de klokkeformede kurvene danner, viser at alle molekylære komponenter finnes i korrekte mengder. Denne teknikken er en kostnadseffektiv metode for å kontrollere flere molekylære komponenter i allergenekstrakter uten en dyr renseprosess og karakterisering.
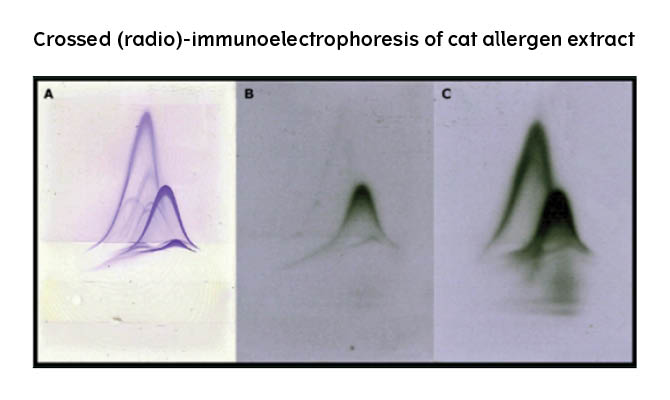
Panel A) Crossed immunoelectrophoresis (CIE) showing blue stained bellshaped antigen-antibody precipitates. Each precipitate represents one antigen.
Panels B and C) Crossed radio-immunoelectrophoresis (CRIE) showing x-ray chromatograms of radio-staining of IgE from individual patients. Each stained precipitate represent reactivity with an allergen that can be identified by comparison with Panel A.
Figur 2. Crossed radio-immunoelectrophoresis
Major- og minor-allergener
Ved analyse av serum fra flere pasienter med krysset immunelektroforese ble det tidlig klart, at for hvert ekstrakt finnes det et eller to molekyler, som gir en sterk IgE-binding hos alle pasienter. Disse såkalte major-allergenene er ofte kvantitativt dominerende når det gjelder molekylsammensetningen i ekstraktene. For eksempel utgjør major-allergenet Bet v 1 i bjørkepollenekstrakt 10–15 % av den samlede proteinmassen i ekstraktet.
I tillegg til ett eller to major-allergener inneholder et allergenprodukt et stort antall minor-allergener som en mindre del av den allergiske populasjon reagerer på.
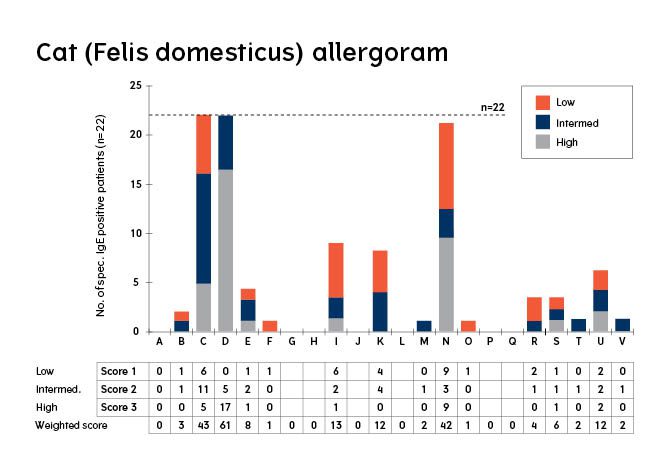
Allergogram showing the number of patients with IgE reactivity towards each of the precipitates identified in figure 1. Preciptates are arbitrarily labeled in alphabetical order from left to right. Allergen D is fel D1. The total number of patients in the analysis is 22. The IgE binding score for each allergen is calculated as the sum of the weighted scores for each patient. Arbitrary weights are assigned as follows: 1 = low IgE binding; 2 = intermediate IgE binding; and 3 = high IgE binding.
Figur 3. Allergogram
Major-allergenene er spesielt viktige for allergenekstraktets potens. For alle SQ-produkter fra ALK kvantifiseres derfor innholdet av major-allergener som en del av ferdigstillingsprosedyren for hver produksjonsenhet. Major-allergenenes store betydning for allergenprodukters potens ble trukket frem allerede i 1998 i WHOs Position Paper on Allergen Immunotherapy.8
En “proof-of-concept”-studie med både renset rekombinant major-allergen og renset naturlig major-allergen fra bjørkepollen viste at allergivaksinasjon med bare major-allergener gir samme kliniske effekter som det fullstendige ekstraktet når det gjelder sikkerhet og effekt.9
Sensibilisering og sykdom
I diskusjoner om diagnostiske tester ved allergi er det viktig å huske at sensibilisering ikke er synonymt med allergisk sykdom. Mange mennesker er sensibilisert mot et allergen, men viser ingen tegn til klinisk sykdom. Sensibilisering er en forutsetning for, men ikke nødvendigvis nok til å forårsake symptomer.
Mange tester som utføres ved kliniske laboratorier, har høy sensitivitet og lav spesifisitet. Grunnen til dette er at allergiske pasienter har allergenspesifikke IgE-antistoffer, men også – i mange tilfeller – høye verdier av allergenspesifikke IgG-antistoffer. For at fastfasen av analysen skal omfatte alle allergenspesifikke antistoffer, må allergenkonsentrasjonen være så høy at IgE ikke utelukkes fra binding gjennom høy IgG-binding til allergenet.
Eksempel 3:
Pasienter som er allergiske mot reker, reagerer ofte på major-allergenet tropomyosin. Homologe varianter av tropomyosin finnes i mange virvelløse dyr, for eksempel husstøvmidd.10 Pasienter med rekeallergi kan derfor teste positivt på husstøvmidd. Tropomyosin er et minor-allergen i husstøvmidd, og disse pasientene bør selvsagt ikke vaksineres mot husstøvmidd, men ideelt sett vaksineres mot reker.
Når en pasient har IgE mot et minor-allergen, men ikke mot major-allergenet innenfor samme art, bør man mistenke kryssreaktivitet. Som regel er det bare pasienter som reagerer med IgE mot major-allergener, som viser klinisk sykdom og derfor sannsynligvis vil ha nytte av behandling med allergivaksinasjon.
Finne balansen
Pasienter med flere sensibiliseringer kan ha nytte av molekylærdiagnostikk eller eventuelt behandles med det allergenet som gir høyest verdi ved en IgE-test.11 Pasienter med klassiske symptomer fra øvre og/eller nedre luftveier med en klar sykehistorie kan diagnostiseres tilstrekkelig ved hjelp av allergenekstrakter, og da er det ikke behov for ytterligere molekylærdiagnostikk.
Referanser :
- Matricardi PM et al.: EAACI Molecular Allergology User’s Guide. Pediatr Allergy Immunol. 2016; 27 Suppl 23:1-250.
- Canonica GW et al.: A WAO – ARIA – GA2LEN consensus document on molecular-based allergy diagnostics. WAO J 2013; 6:17.
- Ipsen H et al.: Specificity mapping of patients IgE response towards the tree pollen major allergens Aln g I, Bet v I and Cor a I. Clin Exp Allergy. 1992; 22(3):391-9.
- Mari A et al.: Fagales pollen sensitization in a birch-free area: a respiratory cohort survey using Fagales pollen extracts and birch recombinant allergens (rBet v 1, rBet v 2, rBet v 4). Clin Exp Allergy. 2003; 33(10):1419-28.
- Müller UR et al.: Hymenoptera venom allergy: analysis of double positivity to honey bee and Vespula venom by estimation of IgE antibodies to species-specific major allergens Api m 1 and Ves v 5. Allergy. 2009; 64(4):543-8.
- Hansen GN, Larsen JN. Immunoelectrophoresis for the characterization of allergen extracts. Methods Mol Med. 2008; 138:147-65.
- Løwenstein H. Quantitative immunoelectrophoretic methods as a tool for the analysis and isolation of allergens. Prog Allergy. 1978; 25:1-62
- Bousquet J et al.(eds): WHO Position Paper – allergen immunotherapy: therapeutic vaccines for allergic diseases. Allergy 1998; 53 (Suppl. 44) 1–42.
- Pauli G et al.: Efficacy of recombinant birch pollen vaccine for the treatment of birch-allergic rhinoconjunctivitis. J Allergy Clin Immunol. 2008; 122:951-60.
- Reese G et al.: Tropomyosin: an invertebrate pan-allergen. Int Arch Allergy Immunol. 1999; 119(4):247-58.
- Stoevesandt J et al.: Single venom-based immunotherapy effectively protects patients with double positive tests to honey bee and Vespula venom. Allergy Asthma Clin Immunol. 2013; 9(1):33.
Relatert lesning
Her er et utvalg andre sider som du kan være interessert i og som er relatert til teksten ovenfor.
Se även vårt Talk – Allergy Knowledge Sharing By ALK

© 2023 ALK – Alle rettigheter forbeholdes.
© 2023 ALK – Alle rettigheter forbeholdes.





